مخلوط گازها با فشار جزئی قانون دالتون. قانون دالتون برای مخلوطی از گازها: فرمولاسیون، مثال استفاده برای حل یک مسئله. نمونه هایی از حل مسئله
مخلوط های گازی قانون دالتون
فشار جزئی بخشی از فشار کل یک مخلوط گازی است که ناشی از گاز یا بخار معین است.گاز جزئی در مخلوط برابر با فشار گاز موجود در مخلوط است که به تنهایی دارد و همان حجمی را اشغال می کند که مخلوط در همان دما اشغال می کند.
قانون دالتوندر غیاب واکنش های شیمیایی، فشار کل مخلوط گاز P کل برابر است با مجموع فشارهای جزئی همه گازهای موجود در آن p 1, p 2, p 3 ..., p n ˸
P کل = p 1 + p 2 + ... + p n. (62)
فشار جزئی یک گاز معین با کسر ᴇᴦο مولکولها از تعداد کل مولکولهای مخلوط (کسری مولی) متناسب است.
p i = P کل · X i = P کل · . (63)
کسر مول X i نسبت تعداد مول های یک ماده داده شده - n i (یا نوع خاصی از ذره) به تعداد کل مول های ماده (یا ذرات) واقع در سیستم n i است.
کسر مول را می توان یا به کل سیستم یا به یک فاز نسبت داد. در حالت دوم، نسبت تعداد مول های یک ماده معین در این فاز به تعداد کل مول های ماده تشکیل دهنده این فاز در نظر گرفته می شود. مجموع کسرهای مولی همه مواد تشکیل دهنده یک سیستم (یا فاز) برابر با واحد است.
ترکیب مخلوط های گازی را می توان با استفاده از قطعات وزنی و حجمی نیز بیان کرد. کسر وزنی یک گاز معین در یک مخلوط، نسبت جرم این گاز به جرم مخلوط گاز است.اگر کسر وزنی گازها را با G 1، G 2، G 3، ...، G i نشان دهیم. و جرم گازهای موجود در مخلوط - از طریق m 1، m 2، m 3، ...، m i و جرم کل مخلوط گاز - از طریق m، سپس به دست می آوریم.
G 1 = G 2 = G 3 = ... G n = (64)
G 1 + G 2 + G 3 + … + G n = 1
m 1 + m 2 + m 3 + … + m n = m.
برای بیان ترکیب یک مخلوط گاز در واحدهای حجمی، لازم است حجم گازهای تشکیل دهنده مخلوط را به یک فشار و دما برسانیم. حجم یک گاز منفرد موجود در یک مخلوط کاهش یافته به فشار مخلوط را حجم کاهش یافته می گویند.برای یافتن حجم کاهش یافته گاز در فشار مخلوط گاز Ptot و دمای T، لازم است از قانون بویل-ماریوت استفاده شود.
p 1 V کل = v 1 P کل; p 2 V total = v 2 P total; p 3 V total = v 3 P total; ... p n V کل = v n P کل،
که در آن v 1، v 2، v 3، ...، v n حجم کاهش یافته گازهای جداگانه ای هستند که مخلوط را تشکیل می دهند. р 1، р 2، р 3، ...، р n - فشار جزئی گازهای منفرد.
v 1 = v 2 = v 3 = …; v n = (65)
مجموع حجم کاهش یافته گازهای منفرد برابر با حجم کل مخلوط است
v 1 + v 2 + v 3 + … + v n = V کل.
نسبت حجم کاهش یافته گازهای منفرد به حجم کل مخلوط را کسر حجمی می گویندو از طریق r˸ بیان می شود
r 1 = r 2 = r 3 = ...; r n = (66)
برای مخلوط های گازی، ترکیب بیان شده توسط کسرهای حجمی و مول یکسان است، یعنی˸
مخلوط های گازی قانون دالتون - مفهوم و انواع. طبقه بندی و ویژگی های دسته "مخلوط های گازی. قانون دالتون" 2015، 2017-2018.
فشار جزئی بخشی از فشار کل یک مخلوط گازی است که ناشی از گاز یا بخار معین است.گاز جزئی در مخلوط برابر با فشار گاز موجود در مخلوط است که به تنهایی دارد و همان حجمی را اشغال می کند که مخلوط در همان دما اشغال می کند.
قانون دالتوندر غیاب واکنش های شیمیایی، فشار کل مخلوط گاز P کل برابر است با مجموع فشارهای جزئی همه گازهای موجود در آن p 1, p 2, p 3 ..., p n:
P کل = p 1 + p 2 + ... + p n. (62)
فشار جزئی یک گاز معین با نسبت مولکول های آن از تعداد کل مولکول های مخلوط (کسری مولی) متناسب است:
p i = P کل · X i = P کل · . (63)
کسر مول X i نسبت تعداد مول های یک ماده داده شده - n i (یا نوع خاصی از ذره) به تعداد کل مول های ماده (یا ذرات) واقع در سیستم n i است.
کسر مول را می توان یا به کل سیستم یا به یک فاز نسبت داد. در حالت دوم، نسبت تعداد مول های یک ماده معین در این فاز به تعداد کل مول های ماده تشکیل دهنده این فاز در نظر گرفته می شود. مجموع کسرهای مولی همه مواد تشکیل دهنده یک سیستم (یا فاز) برابر با واحد است.
ترکیب مخلوط های گازی را می توان با استفاده از قطعات وزنی و حجمی نیز بیان کرد. کسر وزنی یک گاز معین در یک مخلوط، نسبت جرم این گاز به جرم مخلوط گاز است.اگر کسر وزنی گازها را با G 1، G 2، G 3، ...، G i نشان دهیم. و جرم گازهای موجود در مخلوط - از طریق m 1، m 2، m 3، ...، m i و جرم کل مخلوط گاز - از طریق m، سپس به دست می آوریم:
G 1 = G 2 = G 3 = ... G n = (64)
G 1 + G 2 + G 3 + … + G n = 1
m 1 + m 2 + m 3 + … + m n = m.
برای بیان ترکیب یک مخلوط گاز در واحدهای حجمی، لازم است حجم گازهای تشکیل دهنده مخلوط را به یک فشار و دما برسانیم. حجم یک گاز منفرد موجود در یک مخلوط کاهش یافته به فشار مخلوط را حجم کاهش یافته می گویند.برای یافتن حجم کاهش یافته گاز در فشار مخلوط گاز Ptot و دمای T، لازم است از قانون بویل-ماریوت استفاده شود:
p 1 V کل = v 1 P کل; p 2 V total = v 2 P total; p 3 V total = v 3 P total; ... p n V کل = v n P کل،
که در آن v 1، v 2، v 3، ...، v n حجم کاهش یافته گازهای جداگانه ای هستند که مخلوط را تشکیل می دهند. р 1، р 2، р 3، ...، р n - فشار جزئی گازهای منفرد.
v 1 = v 2 = v 3 = …; v n = (65)
مجموع حجم کاهش یافته گازهای مجزا برابر است با حجم کل مخلوط:
v 1 + v 2 + v 3 + … + v n = V کل.
نسبت حجم کاهش یافته گازهای منفرد به حجم کل مخلوط را کسر حجمی می گویندو از طریق r بیان می شود:
r 1 = r 2 = r 3 = ...; r n = (66)
برای مخلوط های گازی، ترکیب بیان شده توسط کسرهای حجمی و مول یکسان است، یعنی:
![]()
![]()
![]() …;
…; ![]() (67)
(67)
میانگین وزن مولکولی یک مخلوط گاز، اگر کسر حجمی گازهای موجود در مخلوط مشخص باشد، با استفاده از فرمول محاسبه می شود:
M av = M 1 r 1 + M 2 r 2 + M 3 r 3 + … + M n r n. (68)
مثال 7.گاز را به شرایط عادی برسانید (حجم V را محاسبه کنید که مقدار معینی از گاز در 273 K و 1.0133 10 5 Pa اشغال می کند)، اگر در 373 K و 1.333 103 Pa حجم آن 3 10 -2 m 3 باشد.
راه حل.با استفاده از رابطه (59) حجم گاز را تعیین می کنیم:
![]()
مثال 8.گاز تحت فشار 1.2 10 5 N/m 2 حجم 4.5 لیتر را اشغال می کند. اگر بدون تغییر دما، حجم به 5.5 لیتر افزایش یابد، فشار چقدر خواهد بود؟
راه حل.با استفاده از قانون بویل-ماریوت (52):
از کجا تهیه کنیم
![]()
مثال 9.حجم جزئی بخار آب، نیتروژن و اکسیژن و فشار جزئی نیتروژن و اکسیژن در هوای مرطوب را محاسبه کنید. حجم کل مخلوط 2 · 10 - 3 متر مکعب است ، فشار کل 1.0133 · 10 5 Pa ، فشار جزئی بخار آب 1.233 · 10 4 Pa است. ترکیب حجمی هوا 21% O 2 و 79 % N 2 است.
راه حل.حجم جزئی بخار آب V را با استفاده از رابطه (65) محاسبه می کنیم:
V= ![]()
ما حجم جزئی O 2 و N 2 را محاسبه می کنیم:
V + V = V - V = 0.002 - 0.00024 = 1.76·10 -3 m3.
V/V = 0.21/0.79.
V = 1.76·10 -3 m3 · 0.21 = 0.37·10 -3 m3;
V = 1.76·10 -3 m3 · 0.79 = 1.39·10 -3 m3.
فشار جزئی O 2 را با استفاده از رابطه (63) محاسبه می کنیم:
P = P x،
x = V / V = 0.37 10 -3 m 3 / 2 10 -3 m 3 = 0.186;
P = 1.0133 10 5 Pa 0.186 = 1.866 10 4 Pa;
و از آنجایی که P = P + P + P، پس
P = 1.0133 10 5 Pa - 1.866 10 4 Pa - 1.233 10 4 Pa = 7.033 10 4 Pa.
انتخاب 1.
5. در شرایط عادی، چگالی دی اکسید کربن 1.977 کیلوگرم بر متر مکعب است. چه فشاری برای فشرده سازی گاز باید اعمال شود تا چگالی آن در دمای 0 درجه سانتیگراد به 10 کیلوگرم بر متر مکعب برسد؟
6. مخلوط گاز شامل 3 m 3 CO 2 گرفته شده در فشار 95940 N/m 2، 4 m 3 O 2 در فشار 106600 N / m 2، 6 m 3 N 2 در فشار 93280 N / متر 2. حجم مخلوط 10 متر مکعب است. فشار جزئی گازهای موجود در مخلوط و فشار کل مخلوط را تعیین کنید (دما ثابت است).
گزینه 2.
5. جرم 1 متر مکعب نیتروژن در دمای 10 درجه سانتیگراد و فشار 9.86·10 4 N/m2 برابر با 1.175 کیلوگرم است. جرم همان حجم نیتروژن تحت فشار 1.092·10 5 N/m 2 در همان دما چقدر است؟
6. هوای خشک تقریباً ترکیب زیر را دارد (جلد٪): N 2 78.09; O 2 20.95; Ar 0.93; CO 2 0.03٪. جرم 40 متر مکعب هوای خشک را در دمای 22 درجه سانتیگراد و فشار معمولی تعیین کنید.
گزینه 3.
5. در دمای 37 درجه سانتیگراد، حجم گاز 0.50 متر مکعب است. اگر فشار ثابت بماند، گاز در 100 درجه سانتیگراد چه حجمی را اشغال می کند؟
6. مخلوط گاز از 3 لیتر CH 4 در فشار 95940 نیوتن بر متر مربع تهیه شد. 4 لیتر H 2 در فشار 83950 نیوتن بر متر مربع و 1 لیتر CO در فشار 108700 نیوتن بر متر مربع. حجم مخلوط 8 لیتر است. فشار جزئی گازها در مخلوط و فشار کل مخلوط را تعیین کنید.
گزینه 4.
5. در دمای 18 درجه سانتیگراد، فشار در سیلندر نیتروژن 1.621·10 6 N/m2 است. در چه دمایی فشار دو برابر می شود؟
گزینه 5.
5. حجم گازهای دودکش را در فشار معمولی محاسبه کنید، اگر حجم آنها در فشار 9.888·10 4 N/m 2 و دمای ثابت برابر با 10 m 3 باشد؟
6. گاز کوره بلند دارای ترکیب تقریبی (حجم درصد) است: CO 28; N 2 3; CO 2 10; N 2 59. اگر فشار کل مخلوط گاز 106400 نیوتن بر متر مربع باشد، فشار جزئی گازهای تشکیل دهنده مخلوط را محاسبه کنید.
گزینه 6.
5. اگر اکسیژن در دمای 0 درجه سانتیگراد 6.242 کیلوگرم بر متر مکعب باشد، تحت چه فشاری قرار دارد؟ چگالی اکسیژن در هیچ 1.429 کیلوگرم بر متر مکعب.
6. گاز تبدیل به گاز زیرزمینی تقریباً دارای ترکیب زیر است (حجم درصد): CO 12; N 2 14; N 2 62.2; CO 2 10 و CH 4 1.8. ترکیب این مخلوط گازها را بر حسب درصد وزنی تعیین کنید.
گزینه 7.
5. فشار اکسیژن در سیلندر در دمای 15 درجه سانتیگراد 1.255·10 7 نیوتن بر متر مربع است. اگر سیلندر تا -33 درجه سانتیگراد خنک شود، فشار گاز چقدر کاهش می یابد؟
6. گاز تولید کننده تقریباً ترکیب زیر را دارد (وزنی %): CO 2 12; N 2 14; CO 20; N 2 54. مقدار هر جزء از گاز ژنراتور را بر حسب حجم محاسبه کنید.
گزینه 8.
5. چند متر مکعب دی اکسید کربن در دمای 22 درجه سانتیگراد و 99289 نیوتن بر متر مربع را می توان با پختن 1000 کیلوگرم سنگ آهک حاوی 90 درصد CaCO 3 به دست آورد؟
6. سیلندر با ظرفیت 20 لیتر در دمای 18 درجه سانتیگراد حاوی مخلوطی از 28 گرم اکسیژن و 24 گرم آمونیاک است. فشار جزئی هر گاز و فشار کل مخلوط را تعیین کنید.
گزینه 9.
5. فشاری که 13.5 گرم مونوکسید کربن در ظرفی با ظرفیت 8 لیتر در دمای 150 درجه سانتیگراد تحت آن قرار می گیرد را تعیین کنید؟
گزینه 10.
5. بالاترین درجه حرارت در مخزن گاز در تابستان 40ºC و کمترین آن در زمستان -30ºC است. یک مخزن گاز با ظرفیت 2000 متر مکعب در زمستان چقدر بیشتر از تابستان در فشار معمولی متان (بر حسب جرم) می تواند نگه دارد؟
6. ظرفی با ظرفیت 2 لیتر حاوی 5.23 گرم نیتروژن و 7.10 گرم هیدروژن است. فشار کل مخلوط گاز را در 25 درجه سانتیگراد محاسبه کنید.
یک مخلوط گاز در حالت تعادل است اگر غلظت اجزا و پارامترهای حالت آن در کل حجم مقادیر یکسانی داشته باشند. در این حالت دمای تمام گازهای موجود در مخلوط یکسان و برابر با دمای مخلوط است تیسانتی متر.
در حالت تعادل، مولکول های هر گاز به طور یکنواخت در کل حجم مخلوط پراکنده می شوند، یعنی غلظت خاص خود را دارند و بنابراین فشار خاص خود را دارند. آر من، پا که نامیده می شود جزئي . به صورت زیر تعریف می شود.
فشار جزئی برابر با فشار یک جزء معین است، مشروط بر اینکه به تنهایی کل حجم در نظر گرفته شده برای مخلوط را در دمای مخلوط T اشغال کند. سانتی متر .
طبق قانون دالتون شیمیدان و فیزیکدان انگلیسی که در سال 1801 فرموله شد، فشار مخلوطی از گازهای ایده آل p سانتی متر برابر با مجموع فشارهای جزئی اجزای آن p من :
جایی که n- تعداد اجزاء
عبارت (2) نیز نامیده می شود قانون فشارهای جزئی
3.3. کاهش حجم یک جزء از مخلوط گاز. قانون آماگ
طبق تعریف، حجم کاهش یافته است منجزء مخلوط گاز V من m3، حجمی است که این یک جزء می تواند اشغال کند، مشروط بر اینکه فشار و دمای آن برابر با فشار و دمای کل مخلوط گاز باشد.
قانون آماگ فیزیکدان فرانسوی که در حدود سال 1870 تدوین شد، می گوید: مجموع حجم های کاهش یافته همه اجزای یک مخلوط برابر با حجم مخلوط است.V سانتی متر :
 ، m 3. (3)
، m 3. (3)
3.4. ترکیب شیمیایی مخلوط گاز
ترکیب شیمیایی مخلوط گاز را می توان مشخص کرد سه متفاوتراه ها.
مخلوط گازی متشکل از n جزء را در نظر بگیرید. مخلوط حجم را اشغال می کند Vسانتی متر، متر 3، جرم دارد مسانتی متر، کیلوگرم، فشار آرسانتی متر، Pa و دما تیسانتی متر، K. همچنین تعداد مول های مخلوط می باشد نسانتی متر، خال در همان زمان، جرم یک منجزء ام متر من، کیلوگرم و تعداد مول های این جزء ν من، خال
بدیهی است که:
 , (4)
, (4)
 . (5)
. (5)
با استفاده از قانون دالتون (2) و قانون آماگ (3) برای مخلوط مورد بررسی، میتوانیم بنویسیم:
 , (6)
, (6)
 , (7)
, (7)
جایی که آر من- فشار جزئی منجزء ام، Pa; V من- کاهش حجم منجزء ام، m3.
بدون ابهام، ترکیب شیمیایی یک مخلوط گاز را می توان با جرم، یا مول یا کسر حجمی اجزای آن مشخص کرد:
 , (8)
, (8)
 , (9)
, (9)
 , (10)
, (10)
جایی که g من , ک من و r من- کسر جرمی، مول و حجمی منجزء ام مخلوط به ترتیب (مقادیر بدون بعد).
بدیهی است که:
 ,
,
 ,
, . (11)
. (11)
اغلب در عمل، ترکیب شیمیایی یک مخلوط در کسری مشخص نمی شود منجزء ام و درصد آن
به عنوان مثال، در مهندسی گرمایش تقریباً فرض می شود که هوای خشک از 79 درصد حجمی نیتروژن و 21 درصد حجمی اکسیژن تشکیل شده است.
درصد من امین جزء در مخلوط با ضرب سهم آن در 100 محاسبه می شود.
به عنوان مثال با هوای خشک خواهیم داشت:
 ,
,
 . (12)
. (12)
جایی که  و
و  - کسر حجمی نیتروژن و اکسیژن در هوای خشک؛ N 2 و O 2 - تعیین درصد حجمی نیتروژن و اکسیژن، به ترتیب، % (جلد).
- کسر حجمی نیتروژن و اکسیژن در هوای خشک؛ N 2 و O 2 - تعیین درصد حجمی نیتروژن و اکسیژن، به ترتیب، % (جلد).
توجه داشته باشید:
1)کسرهای مولی یک مخلوط ایده آل از نظر عددی برابر با کسرهای حجمی هستند:ک من = r من . بیایید ثابت کنیم.
با استفاده از تعریف کسر حجمی(10)و قانون آماگ (3) می توانیم بنویسیم:
 ,
(13)
,
(13)
جایی کهV من - کاهش حجممنجزء ام، m 3
;
ν
من - تعداد خالمنجزء ام، مول؛
 – حجم یک مولمنجزء ام در فشار مخلوط pسانتی متر و دمای مخلوط Tسانتی متر ، م 3
/mol.
– حجم یک مولمنجزء ام در فشار مخلوط pسانتی متر و دمای مخلوط Tسانتی متر ، م 3
/mol.
از قانون آووگادرو (به بند 2.3 این ضمیمه مراجعه کنید) نتیجه می گیرد که در دما و فشار یکسان، یک مول از هر گاز (جزء مخلوط) همان حجم را اشغال می کند. به ویژه، در Tسانتی متر و صسانتی متر مقداری حجم خواهد بودV 1 ، م 3 .
این به ما امکان می دهد برابری را بنویسیم:
 .
(14)
.
(14)
جایگزین کردن(14)V(13)ما آنچه را که نیاز داریم بدست می آوریم:
 .
(15)
.
(15)
2)کسر حجمی اجزای یک مخلوط گازی را می توان با دانستن فشار جزئی آنها محاسبه کرد. بیایید آن را نشان دهیم.
در نظر بگیریممن-مین جزء یک مخلوط گاز ایده آل در دو حالت مختلف: زمانی که در فشار جزئی خود باشد p من ; زمانی که حجم کاهش یافته خود را اشغال می کندV من .
معادله حالت یک گاز ایده آل برای هر یک از حالات آن، به ویژه برای دو حالت فوق معتبر است.
بر این اساس و با در نظر گرفتن تعریف حجم خاص می توان نوشت:
 ,
(16)
,
(16)
 ,
(17)
,
(17)
جایی کهآر من - ثابت گازمنامین جزء مخلوط، J/(kg K).
پس از تقسیم هر دو قسمت(16)و(17)بر روی یکدیگر موارد مورد نیاز را دریافت می کنیم:
 .
(18)
.
(18)
از جانب(18)می توان مشاهده کرد که فشار جزئی اجزای مخلوط را می توان از ترکیب شیمیایی آن با فشار کل مشخص مخلوط p محاسبه کرد.سانتی متر :
 .
(19)
.
(19)
در عمل، اغلب گازهای خالص نیستند، بلکه مخلوطی از آنها هستند. اجزای مخلوط حجم یکسانی دارند و دمای یکسانی دارند. غلظت مخلوط برابر است با مجموع غلظت اجزای مخلوط، یعنی.
سپس طبق فرمول (4.5) فشار مخلوط برابر است با:
اجازه دهید نماد زیر را معرفی کنیم:
جایی که ![]() - فشارهای جزئی
- فشارهای جزئی
به طور کلی، برای توصیف حرکت ریزذرات، لازم است قوانین مکانیک کوانتومی اعمال شود. فیزیک آماری که ماکروسیستم هایی متشکل از ریزذرات را توصیف می کند که حرکت آنها توسط قوانین مکانیک کوانتومی توصیف می شود، نامیده می شود. آمار کوانتومی.
یکی از مفاهیم اساسی آمار (اعم از کلاسیک و کوانتومی) این است احتمال. بگذارید هر سیستم فیزیکی در حالت های فیزیکی متفاوت باشد. اجازه دهید فرض کنیم که این حالت ها گسسته هستند، یعنی. کمیت های فیزیکی که آنها را مشخص می کند در پرش ها تغییر می کنند و هر حالت با مقدار معینی x i از مقدار فیزیکی x مشخص می شود.
در برخی از ایالت ها سیستم زمان بیشتری را صرف می کند، در برخی دیگر زمان کمتری را صرف می کند. مقدار x را چند بار N اندازهگیری میکنیم. اجازه دهید N i را به تعداد اندازهگیریها نشان دهیم، که هر یک مقدار کمیت اندازهگیری شده x را برابر با x i میدهد. احتمال w i که مقدار x مقدار x i را داشته باشد حد نسبت عدد N i به تعداد کل ابعاد N نامیده می شود زیرا N به سمت بی نهایت میل می کند، یعنی:
 (1.16)
(1.16)
مقدار گسسته مقادیر فیزیکی یک ویژگی مشخصه همه ریز ذرات (اتم ها، مولکول ها) است. به عنوان مثال، انرژی حرکت چرخشی و ارتعاشی یک مولکول تنها می تواند به طور گسسته، در پرش ها تغییر کند. به چنین کمیتی گفته می شود که کوانتیزه می شود.
در عین حال، میتوانیم با دقت زیادی فرض کنیم که انرژی حرکت انتقالی مولکولها کوانتیزه نشده است، یعنی. به طور مداوم تغییر می کند، به این معنی که سرعت مولکول های گاز و همچنین مختصات مولکول ها در فضا تغییر می کند. برای یک متغیر تصادفی پیوسته، به عنوان مثال، سرعت یک مولکول v، احتمال dw v که سرعت یک مولکول v مقادیری را در بازه بین v تا v + dv بگیرد به صورت زیر محاسبه می شود:
 (1.17)
(1.17)
در اینجا N تعداد کل اندازهگیریهای سرعت است، dN v تعداد اندازهگیریهایی است که در آن سرعت مولکول در بازه v تا v + dv کاهش یافته است.
بدیهی است که:
این از تعریف احتمال (1.17) به دست می آید:
همین امر برای یک متغیر تصادفی پیوسته نیز صادق است. از (1.18) چنین است که:
 (1.19)
(1.19)
فرمول فشارسنجی
فرمول بارومتریک وابستگی فشار p یک گاز ایده آل واقع در یک میدان گرانشی یکنواخت در دمای ثابت T را به ارتفاع z نشان می دهد:
 (1.20)
(1.20)
که در آن p o فشار در z = 0 است، m o جرم مولکول، k ثابت بولتزمن است.
توزیع بولتزمن
ماکسول رابطه زیر را بدست آورد:
 (1.23)
(1.23)
در اینجا احتمال تشخیص یک مولکول در یک متوازی الاضلاع مستطیلی بی نهایت کوچک در فضای سرعت نشان داده شده در شکل 1 است. 1.3.

به عبارت دیگر، این احتمال وجود دارد که مولکول بر روی محور x در بازه v x تا v x + dv x و در فواصل مشابه برای مقادیر v y و v z، سرعت پیش بینی داشته باشد.
از (1.23) واضح است که احتمال به جهت بردار بستگی ندارد، بلکه فقط به مدول آن بستگی دارد. بنابراین، در فرمول (1.23) به عنوان یک حجم ابتدایی در فضای سرعت، به جای یک متوازی الاضلاع مستطیلی، می توانیم یک لایه کروی بی نهایت نازک (نگاه کنید به شکل 1.4) که شعاع آن v و ضخامت آن dv است. در این حجم ابتدایی، تمام ماژول های سرعت با انحراف بیش از dv برابر با v هستند. بنابراین اجازه دهید از dv x، dv y، dv z به 4πv 2 dv حرکت کنیم، جایی که 4πv 2 مساحت کره در فضای سرعت است که در شکل نشان داده شده است. 1.4.

پس از آن فرمول (1.23) به شکل زیر در می آید:
 (1.24)
(1.24)
فرمول (1.24) معمولاً به صورت زیر نوشته می شود:
![]() (1.25)
(1.25)
جایی که  (1.26)
(1.26)
دریافت شده توسط D.K. تابع ماکسول F(v) معمولاً تابع توزیع احتمال یا تابع توزیع ماکسول نامیده می شود.
از (1.25) چنین می شود که:
![]()
بنابراین به F(v) چگالی احتمال نیز گفته می شود.
نمودار تابع توزیع ماکسول در شکل نشان داده شده است. 1.5.

در پایان قرن هجدهم و در نیمه اول قرن نوزدهم، دانشمندان کشورهای مختلف به طور فعال رفتار مواد گازی، مایع و جامد را تحت شرایط مختلف خارجی مورد مطالعه قرار دادند و تحقیقات خود را بر اساس ایدههایی در مورد ساختار اتمی و مولکولی ماده انجام دادند. یکی از این دانشمندان قانون بریتانیا برای مخلوطی از گازها بود که در حال حاضر نام او را یدک می کشد، در این مقاله مورد بحث قرار می گیرد.
شرایط خاص
قبل از تدوین قانون دالتون برای مخلوط گازها، باید یکی از مفاهیم را درک کرد. این بسیار مهم است، زیرا این قانون فقط برای چنین ماده ای معتبر است. ما در مورد گاز ایده آل صحبت می کنیم. چیست؟
گاز ایده آل گازی است که شرایط زیر برای آن اعمال می شود:
- اندازه مولکول ها و اتم ها در آن به قدری کوچک است که می توان آنها را نقاط مادی با حجم صفر در نظر گرفت.
- مولکول ها و اتم ها با یکدیگر تعامل ندارند.
بنابراین، یک گاز ایده آل مجموعه ای از نقاط مادی است که به طور تصادفی حرکت می کنند. سرعت حرکت و جرم آنها به طور منحصر به فردی دمای کل مخلوط را تعیین می کند. فشاری که ماده آزمایش بر دیواره های ظرف وارد می کند به پارامترهای ماکروسکوپی مانند دما، حجم ظرف و تعداد مولکول ها بستگی دارد.
برای چنین مدل گازی برابری معتبر است:
نامیده می شود و فشار (P)، دما (T)، حجم (V) و مقدار ماده در مول (n) را ترکیب می کند. مقدار R ضریب تناسب است که برابر با 8.314 J/(K*mol) است.
نکته شگفتانگیز در مورد این فرمول این است که شامل یک پارامتر واحد نمیشود که به ماهیت شیمیایی مولکولها و اتمها بستگی داشته باشد.
فشار جزئی
قانون دالتون برای مخلوطی از گازهای ایده آل مستلزم آگاهی از یک پارامتر ماکروسکوپی دیگر - فشار جزئی است.
بیایید فرض کنیم که مخلوطی از 2 جزء وجود دارد، به عنوان مثال، H 2 و He. این مخلوط در ظرفی با حجم مشخص قرار دارد و فشار معینی بر روی دیواره های آن ایجاد می کند. از آنجایی که مولکولهای هیدروژن و اتمهای هلیوم با یکدیگر برهمکنش نمیکنند، بنابراین برای هر گونه محاسبات ویژگیهای ماکروسکوپی، هر دو جزء را میتوان مستقل از یکدیگر در نظر گرفت.
فشار جزئی یک جزء فشاری است که به طور مستقل از سایر اجزای مخلوط ایجاد می کند و حجمی را که به آن داده می شود را اشغال می کند. در مثال مورد بررسی می توان از فشار جزئی H 2 و همین ویژگی ها برای He صحبت کرد. این مقدار با پاسکال بیان می شود و برای جزء i به صورت Pi نشان داده می شود.
مخلوط های گازی و قانون دالتون

جان دالتون، با مطالعه مواد فرار مختلف، از جمله بخار آب، در دماها و فشارهای مختلف، به این نتیجه رسید: فشار مخلوطی از مواد کاملاً مشابه به هر نسبتی برابر است با مجموع فشارهای جزئی همه اجزای آن. این فرمول قانون دالتون برای فشار مخلوط گازها نامیده می شود و به صورت زیر نوشته می شود:
در اینجا P tot فشار کل مخلوط است.
این قانون نسبتاً ساده فقط برای مخلوطهای گازی ایدهآل صادق است که اجزای آنها با یکدیگر واکنش شیمیایی ندارند.
فرمول دیگری از قانون دالتون

قانون دالتون برای مخلوطی از گازها را می توان نه تنها بر حسب فشار جزئی، بلکه بر حسب کسر مولی هر جزء بیان کرد. فرمول مربوطه را بدست می آوریم.
از آنجایی که هر جزء در مخلوط گاز مستقل از سایر اجزاء رفتار می کند، پس می توان معادله حالت را برای آن نوشت:
این معادله برای هر جزء iم معتبر است، زیرا برای همه آنها دمای T و حجم V یکسان است. مقدار n i تعداد مول های جزء i در مخلوط است.
اکنون فشار جزئی را بیان می کنیم و آن را بر فشار کل کل مخلوط تقسیم می کنیم، سپس به دست می آوریم:
P i /P tot = n i *R*T / V / (n *R*T/V) = n i /n
در اینجا n مقدار کل ماده در کل مخلوط است. با جمع کردن همه n i می توان آن را به دست آورد. نسبت n i /n را کسر مولی جزء i در مخلوط می گویند. معمولاً با علامت x i نشان داده می شود. برحسب کسرهای مول، قانون دالتون به صورت زیر نوشته شده است:
اغلب به صورت درصد اتمی اجزای یک مخلوط نشان داده می شود. به عنوان مثال، 21٪ O 2 در هوا به این معنی است که کسر مولی آن 0.21 است، یعنی هر پنجمین مولکول هوا اکسیژن است.
اعمال قانون مد نظر برای حل مشکل

مشخص است که مخلوط گازی از اکسیژن و نیتروژن در یک سیلندر تحت فشار 5 اتمسفر قرار دارد. با علم به اینکه حاوی 10 مول نیتروژن و 3 مول اکسیژن است، باید فشار جزئی هر ماده را تعیین کرد.
برای پاسخ به سؤال، ابتدا مقدار کل ماده را پیدا می کنیم:
n = n N2 + n O2 = 10 + 3 = 13 مول
x N2 = n N2 / n = 10/13 = 0.7692
x O2 = n O2 / n = 3/13 = 0.2308
با استفاده از فرمول قانون دالتون از طریق کسر مولی یک جزء، فشار جزئی هر گاز در سیلندر را محاسبه می کنیم:
P N2 = 5 * 0.7692 = 3.846 اتمسفر.
P O2 = 5 * 0.2308 = 1.154 اتمسفر.
همانطور که از ارقام به دست آمده مشخص است، مجموع این فشارها 5 اتمسفر خواهد بود. فشار جزئی هر گاز با کسر مولی آن در مخلوط نسبت مستقیم دارد.
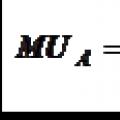 محصول نهایی کار برابر با فرمول است
محصول نهایی کار برابر با فرمول است اجرای کار طراحی و نقشه برداری
اجرای کار طراحی و نقشه برداری سیستم های ردوکس سیستم های ردوکس برگشت پذیر و غیر قابل برگشت
سیستم های ردوکس سیستم های ردوکس برگشت پذیر و غیر قابل برگشت