Om värmeenergi på ett enkelt språk! Mängd värme. Enheter för mängden värme. Specifik värme. Beräkning av mängden värme som krävs för att värma en kropp eller avges av den under kylning Hur mycket värme krävs för m gram vatten
Människan känner till få typer av energi - mekanisk energi (kinetisk och potential), intern energi (termisk), fältenergi (gravitationell, elektromagnetisk och nukleär), kemisk. Separat är det värt att lyfta fram energin i explosionen, ...
Energin i vakuumet och fortfarande existerar endast i teorin - mörk energi. I den här artikeln, den första i rubriken "Värmeteknik", ska jag försöka på ett enkelt och tillgängligt språk, med hjälp av ett praktiskt exempel, prata om den viktigaste energiformen i människors liv - om värmeenergi och om att föda henne i tid värmekraft.
Några ord för att förstå platsen för värmeteknik som en gren av vetenskapen om att erhålla, överföra och använda termisk energi. Modern värmeteknik har vuxit fram ur allmän termodynamik, som i sin tur är en av fysikens grenar. Termodynamik är bokstavligen "varm" plus "kraft". Således är termodynamik vetenskapen om att "ändra temperaturen" i ett system.
Påverkan på systemet utifrån, där dess inre energi förändras, kan vara resultatet av värmeöverföring. Värmeenergi, som förvärvas eller förloras av systemet som ett resultat av sådan interaktion med omgivningen, kallas mängden värme och mäts i SI-enheter i joule.
Om du inte är en värmetekniker och inte hanterar värmetekniska frågor dagligen, då när du står inför dem, ibland utan erfarenhet, är det mycket svårt att snabbt förstå dem. Det är svårt, utan erfarenhet, att ens föreställa sig dimensionaliteten hos de sökta värdena för mängden värme och värmekraft. Hur många Joule energi behövs för att värma 1000 kubikmeter luft från en temperatur på -37˚C till + 18˚C? .. Vilken effekt av en värmekälla behövs för att göra detta på 1 timme? "Inte alla ingenjörer. Ibland kommer specialister till och med ihåg formlerna, men bara ett fåtal kan tillämpa dem i praktiken!
Efter att ha läst den här artikeln till slutet kan du enkelt lösa verkliga industriella och hushållsproblem i samband med uppvärmning och kylning av olika material. Att förstå den fysiska karaktären hos värmeöverföringsprocesser och känna till enkla grundformler är de viktigaste byggstenarna i grunden för kunskap inom värmeteknik!
Mängden värme i olika fysiska processer.
De flesta av de kända ämnena kan vara i fasta, flytande, gasformiga eller plasmatillstånd vid olika temperaturer och tryck. Övergång från ett aggregeringstillstånd till ett annat sker vid konstant temperatur(förutsatt att trycket och andra miljöparametrar inte ändras) och åtföljs av absorption eller frigöring av termisk energi. Trots det faktum att 99% av materia i universum är i plasmatillstånd, kommer vi inte att överväga detta aggregationstillstånd i den här artikeln.
Betrakta grafen som visas i figuren. Det visar beroendet av ämnets temperatur T på mängden värme F, förs till ett visst slutet system som innehåller en viss massa av ett visst ämne.

1. Fast kropp med temperatur T1, värm upp till temperatur Tm, spendera på denna process en mängd värme lika med Q1 .
2. Därefter börjar smältprocessen, som sker vid en konstant temperatur. TPL(smältpunkt). För att smälta hela massan av ett fast ämne är det nödvändigt att förbruka värmeenergi i en mängd Q2 - Q1 .
3. Därefter värms vätskan som härrör från smältningen av det fasta ämnet till kokpunkten (gasbildning) Tkp, spendera på denna mängd värme lika med Q3-Q2 .
4. Nu vid konstant kokpunkt Tkp vätskan kokar och avdunstar och förvandlas till en gas. För överföring av hela massan av vätska till gas är det nödvändigt att förbruka termisk energi i en mängd Q4-Q3.
5. I det sista steget värms gasen upp från temperaturen Tkp till en viss temperatur T2... I det här fallet kommer kostnaden för mängden värme att vara F5-Q4... (Om vi värmer gasen till joniseringstemperaturen förvandlas gasen till plasma.)
Således värma den ursprungliga fasta från temperatur T1 till temperatur T2 vi har använt värmeenergi i mängden F5, överföra materia genom tre aggregationstillstånd.
Om vi rör oss i motsatt riktning kommer vi att ta bort samma mängd värme från ämnet. F5 som passerar genom stadierna av kondensation, kristallisation och kylning från temperatur T2 till temperatur T1... Självklart överväger vi ett slutet system utan energiförlust till den yttre miljön.
Observera att en övergång från ett fast tillstånd till ett gasformigt tillstånd är möjlig, förbi den flytande fasen. En sådan process kallas sublimering, och den omvända processen kallas desublimering.
Så de insåg att processerna för övergångar mellan tillstånden för aggregation av materia kännetecknas av förbrukningen av energi vid en konstant temperatur. När ett ämne värms upp, som är i ett konstant aggregationstillstånd, stiger temperaturen och värmeenergi förbrukas också.
Huvudformlerna för värmeöverföring.
Formlerna är väldigt enkla.
Mängd värme F i J beräknas med formlerna:
1. Från sidan av värmeförbrukningen, det vill säga från lastsidan:
1.1. Vid uppvärmning (kylning):
F = m * c * (T2-T1)
m – ämnets massa i kg
med - specifik värmekapacitet för ett ämne i J / (kg * K)
1.2. Vid smältning (frysning):
F = m * λ
λ – specifik smältvärme och kristallisation av ett ämne i J / kg
1.3. Kokning, avdunstning (kondensering):
F = m * r
r – specifik värme för gasbildning och kondensation av ett ämne i J / kg
2. Från värmeproduktionssidan, det vill säga från källsidan:
2.1. Under bränsleförbränning:
F = m * q
q – specifik värme för förbränning av bränsle i J / kg
2.2. Vid omvandling av elektricitet till termisk energi (Joule-Lenz lag):
Q = t * I * U = t * R * I ^ 2 = (t / R)*U ^ 2
t – tid i s
jag – effektiv ström i A
U – effektivt spänningsvärde i V
R – belastningsmotstånd i ohm
Vi drar slutsatsen att mängden värme är direkt proportionell mot ämnets massa under alla fasomvandlingar och, när den värms upp, dessutom är direkt proportionell mot temperaturskillnaden. Proportionalitetskoefficienterna ( c , λ , r , q ) för varje ämne har sina egna värden och bestäms empiriskt (hämtade från referensböcker).
Värmekraft N i W är mängden värme som överförs till systemet under en viss tid:
N = Q/t
Ju snabbare vi vill värma upp kroppen till en viss temperatur, desto mer kraft bör termisk energikälla ha - allt är logiskt.
Beräkning i Excel av ett tillämpat problem.
I livet är det ofta nödvändigt att göra en snabb uppskattningsberäkning för att förstå om det är vettigt att fortsätta studera ämnet, göra ett projekt och detaljerade noggranna arbetsintensiva beräkningar. Efter att ha gjort en beräkning på några minuter, även med en noggrannhet på ± 30 %, kan du fatta ett viktigt ledningsbeslut, som blir 100 gånger billigare och 1000 gånger mer operativt och som ett resultat 100 000 gånger effektivare än att utföra en exakt beräkning inom en vecka, annars och en månad, av en grupp dyra specialister ...
Villkor för problemet:
I verkstadens lokaler för beredning av metallvalsning med dimensioner 24m x 15m x 7m importerar vi metallprodukter i mängden 3 ton från ett lager på gatan. Den valsade metallen har is med en totalvikt på 20 kg. På gatan -37˚С. Hur mycket värme behövs för att värma metallen till + 18˚С; värm isen, smält den och värm vattnet till + 18˚С; värma hela luftvolymen i rummet, förutsatt att värmen var helt avstängd tidigare? Vilken kapacitet ska värmesystemet ha om allt ovanstående måste göras på 1 timme? (Mycket hårda och nästan orealistiska förhållanden - speciellt när det kommer till luft!)
Vi kommer att utföra beräkningen i programmetMS Excel eller i programmetOOo Beräknat.
För färgformatering av celler och teckensnitt, se sidan "".
Initial data:
1. Vi skriver namnen på ämnena:
till cell D3: Stål
till cell E3: Is
in i cell F3: Isvatten
till cell G3: Vatten
till cell G3: Luft
2. Vi anger namnen på processerna:
in i cellerna D4, E4, G4, G4: värme
in i cell F4: smältande
3. Specifik värme av ämnen c i J / (kg * K) skriver vi för stål, is, vatten respektive luft
till cell D5: 460
till cell E5: 2110
till cell G5: 4190
till cell H5: 1005
4. Specifik värme vid smältning av is λ i J/kg anger vi
till cell F6: 330000
5. Massa av ämnen m i kg anger vi för stål respektive is
till cell D7: 3000
till cell E7: 20
Eftersom massan inte förändras när is förvandlas till vatten alltså
i cellerna F7 och G7: = E7 =20
Vi finner luftmassan genom produkten av rummets volym genom den specifika vikten
i cell H7: = 24 * 15 * 7 * 1,23 =3100
6. Processtid t i min skriver vi bara en gång för stål
till cell D8: 60
Tiderna för uppvärmning av is, smältning av den och uppvärmning av det resulterande vattnet beräknas utifrån villkoret att alla dessa tre processer måste slutföras på samma tid som det är avsatt för uppvärmning av metallen. Vi läser därefter
i cell E8: = E12 / (($ E $ 12 + $ F $ 12 + $ G $ 12) / D8) =9,7
i cell F8: = F12 / (($ E $ 12 + $ F $ 12 + $ G $ 12) / D8) =41,0
i cell G8: = G12 / (($ E $ 12 + $ F $ 12 + $ G $ 12) / D8) =9,4
Luften måste också värmas upp under samma tilldelade tid, läs
i cell H8: = D8 =60,0
7. Den initiala temperaturen för alla ämnen T1 i ˚C går vi in
till cell D9: -37
till cell E9: -37
till cell F9: 0
till cell G9: 0
till cell H9: -37
8. Sluttemperaturen för alla ämnen T2 i ˚C går vi in
till cell D10: 18
till cell E10: 0
till cell F10: 0
till cell G10: 18
till cell H10: 18
Jag tycker att det inte ska finnas några frågor om paragraf 7 och 8.

Beräkningsresultat:
9. Mängd värme F i KJ beräknar vi vad som krävs för var och en av processerna
för uppvärmning av stål i cell D12: = D7 * D5 * (D10-D9) / 1000 =75900
för uppvärmning av is i fack E12: = E7 * E5 * (E10-E9) / 1000 = 1561
att smälta is i cell F12: = F7 * F6 / 1000 = 6600
för uppvärmning av vatten i cell G12: = G7 * G5 * (G10-G9) / 1000 = 1508
för uppvärmning av luft i cell H12: = H7 * H5 * (H10-H9) / 1000 = 171330
Vi läser av den totala mängden värmeenergi som krävs för alla processer
i sammanslagen cell D13E13F13G13H13: = SUMMA (D12: H12) = 256900
I cellerna D14, E14, F14, G14, H14 och i den kombinerade cellen D15E15F15G15H15 anges värmemängden i bågmåttenheten - i Gcal (i gigakalorier).
10. Värmekraft N i kW, som krävs för var och en av processerna beräknas
för uppvärmning av stål i cell D16: = D12 / (D8 * 60) =21,083
för uppvärmning av is i cell E16: = E12 / (E8 * 60) = 2,686
att smälta is i cell F16: = F12 / (F8 * 60) = 2,686
för uppvärmning av vatten i cell G16: = G12 / (G8 * 60) = 2,686
för uppvärmning av luft i cell H16: = H12 / (H8 * 60) = 47,592
Den totala termiska effekt som krävs för att slutföra alla processer i tid t beräknad
i sammanslagen cell D17E17F17G17H17: = D13 / (D8 * 60) = 71,361
I cellerna D18, E18, F18, G18, H18 och i den kombinerade cellen D19E19F19G19H19 ges den termiska effekten i bågmåttenheten - i Gcal / timme.
Detta avslutar beräkningen i Excel.
Slutsatser:
Observera att uppvärmning av luften kräver mer än dubbelt så mycket energi som att värma samma stålmassa.
Vid uppvärmning av vatten är energiförbrukningen dubbelt så stor som vid uppvärmning av is. Smältprocessen förbrukar många gånger mer energi än uppvärmningsprocessen (med en liten temperaturskillnad).
Uppvärmningsvatten förbrukar tio gånger mer värmeenergi än uppvärmning av stål och fyra gånger mer än uppvärmning av luft.
För tar emot information om utgivningen av nya artiklar och för nedladdning av fungerande programfiler Jag ber dig att prenumerera på meddelanden i fönstret som finns i slutet av artikeln eller i fönstret högst upp på sidan.
Efter att ha angett din e-postadress och klickat på knappen "Ta emot artikelmeddelanden". GLÖM INTEBEKRÄFTA PRENUMERERA genom att klicka på länken i ett brev som omedelbart kommer till dig till den angivna posten (ibland - till mappen « Spam » )!
Vi kom ihåg begreppen "mängd värme" och "termisk kraft", betraktade de grundläggande formlerna för värmeöverföring och analyserade ett praktiskt exempel. Jag hoppas att mitt språk var enkelt, tydligt och intressant.
Jag väntar på frågor och kommentarer om artikeln!
jag ber RESPEKT nedladdningsfil för författarens verk EFTER PRENUMERATION för artikelmeddelanden.
Per definition är en kalori mängden värme som krävs för att värma en kubikcentimeter vatten med 1 grad Celsius. En gigakalori, som används för att mäta värmeenergi i värmekraftsindustrin och kraftverk, är en miljard kalorier. På 1 meter finns det 100 centimeter, därför i en kubikmeter - 100 x 100 x 100 = 1 000 000 centimeter. Alltså att värma en kub vatten med
1 grad behöver du en miljon kalorier eller 0,001 Gcal.
I min stad är priset på uppvärmning 1132,22 rubel / Gcal, och priset på varmvatten är 71,65 rubel / kubikmeter, priset på kallt vatten är 16,77 rubel / kubikmeter.
Hur mycket Gcal går åt för att värma 1 kubikmeter vatten?
jag tror det
s x 1132,22 = 71,65 - 16,77 och därmed löser jag ekvationerna för att ta reda på vad s (Gcal) är lika med, det vill säga det är lika med 0,0484711452 Gcal
Jag tvivlar på det, enligt min mening bestämmer jag fel
SVAR:
Jag hittar inga fel i din beräkning.
Naturligtvis bör de givna tarifferna inte inkludera kostnaden för avloppsvatten (avloppshantering).
En ungefärlig beräkning för staden Izhevsk enligt de gamla standarderna ser ut så här:
0,19 Gcal per person och månad (denna norm har nu upphävts, men det finns ingen annan, till exempel duger den) / 3,6 kubikmeter. per person och månad (norm för varmvattenförbrukning) = 0,05278 Gcal per 1 kubikmeter. (liksom mycket värme behövs för att värma 1 kubikmeter kallt vatten till standardtemperaturen för varmvatten, som, minns, är 60 grader C).
För en mer exakt beräkning av mängden värmeenergi för uppvärmning av vatten med den direkta metoden baserad på fysiska kvantiteter (och inte på motsatt sätt baserat på de godkända tarifferna för varmvattenförsörjning) - rekommenderar jag att du använder mall för beräkning av tariffen för varmvatten (REC UR)... Beräkningsformeln använder bland annat kallvattentemperaturen under sommar- och vinterperioder (uppvärmning), varaktigheten av dessa perioder.
Taggar: gigakalori, varmvatten
- Vi betalar för varmvattenförsörjningstjänster, temperaturen är mycket lägre än standarden. Vad ska man göra?
- Varaktigheten av avstängningsperioden för varmvatten som fastställts i reglerna är inte olaglig - beslutet från Ryska federationens högsta domstol (2017)
- Initiativ för att upprätta rättvisare tariffer och mätmetodik för varmvattenförbrukning
- Om förfarandet för omräkning av betalningsbeloppet för uppvärmning och varmvattenförsörjning vid avbrott - förklaring av Rospotrebnadzor för UR
- Om mätning av kylvätskan i ett slutet värmeförsörjningssystem - brev från Ryska federationens byggministerium daterat 03.31.2015 nr 9116-OD / 04
- UR - Om sänkning av betalningen för värme och varmvattenförsörjning - skrivelse från Energidepartementet UR daterad 2015-08-17 nr 11-10 / 5661
- Vilken är standardperioden för att kalibrera en vanlig husmätare för uppvärmning och varmvattenförsörjning?
- Smutsigt varmt kranvatten. Vart kontakta?
- Kan vattenmätaren i lägenheten skruvas upp för hela entrén? Hur man betalar? Månatliga avläsningar - 42 kubikmeter
- Förfarandet för att upprätthålla separat redovisning av kostnader inom området för vattenförsörjning och avloppsvatten - order från Ryska federationens byggministerium daterad 25 januari 2014 nr 22 / pr
- betalning för vatten och el i lägenhet utan boende
- värmeberäkning enligt ODPU med 1/12
- Strömförsörjning
- Stora betalningar för ett studentrum (17,3 kvm)
| Kommentarer: (11) | |
| Tips: Dela länken på sociala medier om du vill ha fler svar/kommentarer! | |
(eller värmeöverföring).
Specifik värme hos ett ämne.
VärmekapacitetÄr mängden värme som absorberas av kroppen när den värms upp med 1 grad.
Värmekapaciteten hos en kropp indikeras med en stor latinsk bokstav MED.
Vad bestämmer kroppens värmekapacitet? Först och främst från dess massa. Det är klart att uppvärmning av till exempel 1 kilo vatten kommer att kräva mer värme än att värma 200 gram.
Och från vilken typ av substans? Låt oss göra ett experiment. Ta två identiska kärl och häll 400 g vatten i en av dem och 400 g vegetabilisk olja i den andra, vi börjar värma dem med identiska brännare. Genom att observera termometrarnas avläsningar kommer vi att se att oljan värms upp snabbt. För att värma vatten och olja till samma temperatur måste vattnet värmas upp längre. Men ju längre vi värmer vattnet, desto mer värme får det från brännaren.
För att värma samma massa av olika ämnen till samma temperatur krävs alltså en annan mängd värme. Mängden värme som krävs för att värma en kropp och därför dess värmekapacitet beror på vilken typ av ämne som utgör denna kropp.
Så, till exempel, för att öka temperaturen på vatten med en massa av 1 kg med 1 ° C, krävs en mängd värme lika med 4200 J, och för att värma samma massa solrosolja med 1 ° C, en mängd av värme lika med 1700 J krävs.
En fysisk storhet som visar hur mycket värme som krävs för att värma 1 kg av ett ämne med 1 ºС kallas specifik värme av detta ämne.
Varje ämne har sin egen specifika värme, som betecknas med den latinska bokstaven c och mäts i joule per kilogram-grad (J / (kg · ° C)).
Den specifika värmekapaciteten för samma ämne i olika aggregationstillstånd (fast, flytande och gasformig) är olika. Till exempel är den specifika värmekapaciteten för vatten 4200 J / (kg · ºС), och den specifika värmekapaciteten för is är 2100 J / (kg · ° С); aluminium i fast tillstånd har en specifik värme lika med 920 J / (kg - ° С), och i flytande tillstånd - 1080 J / (kg - ° С).
Observera att vatten har en mycket hög specifik värme. Därför absorberar vattnet i haven och oceanerna, som värms upp på sommaren, en stor mängd värme från luften. Tack vare detta, på de platser som ligger nära stora vattendrag, är sommaren inte lika varm som på platser långt från vattnet.
Beräkning av mängden värme som krävs för att värma en kropp eller som avges av den under kylning.
Av ovanstående är det tydligt att mängden värme som krävs för att värma en kropp beror på vilken typ av substans som kroppen består av (d.v.s. dess specifika värmekapacitet) och på kroppens massa. Det är också tydligt att mängden värme beror på hur många grader vi ska öka kroppstemperaturen.
Så för att bestämma mängden värme som krävs för att värma en kropp eller avges av den under kylning, måste kroppens specifika värme multipliceras med dess massa och med skillnaden mellan dess slutliga och initiala temperaturer:
F = centimeter (t 2 - t 1 ) ,
var F- mängd värme, c- specifik värme, m- kroppsmassa , t 1 - initial temperatur, t 2 - slutlig temperatur.
När kroppen är uppvärmd t 2> t 1 och därför F > 0 ... Vid kylning av kroppen t 2 och< t 1 och därför F< 0 .
Om hela kroppens värmekapacitet är känd MED, F bestäms av formeln:
Q = C (t 2 - t 1 ) .
730. Varför används vatten för att kyla vissa mekanismer?
Vatten har en hög specifik värme, vilket bidrar till god värmeavledning från mekanismen.
731. I vilket fall är det nödvändigt att spendera mer energi: att värma en liter vatten med 1 ° C eller att värma hundra gram vatten med 1 ° C?
För att värma en liter vatten, eftersom ju större massa, desto mer energi behöver du spendera.
732. Cupronickel och silvergafflar af samma massa doppades i hett vatten. Kommer de att få lika mycket värme i vattnet?
Cupronickel-pluggen kommer att få mer värme, eftersom den specifika värmen för cupronickel är högre än den för silver.
733. En bit bly och en bit gjutjärn av samma massa slogs tre gånger med en slägga. Vilken bit är hetast?
Bly värms upp mer eftersom det har en lägre specifik värme än gjutjärn och kräver mindre energi för att värma blyet.
734. I den ena kolven finns vatten, i den andra finns fotogen med samma massa och temperatur. En lika uppvärmd järnkub kastades i varje kolv. Vilket värms upp till en högre temperatur - vatten eller fotogen?
Fotogen.
735. Varför är temperaturfluktuationerna på vintern och sommaren mindre kraftiga i städer vid kusten än i städer som ligger i det inre av kontinenten?
Vatten värms upp och kyls långsammare än luft. På vintern svalnar den och flyttar varma luftmassor till land, vilket gör klimatet vid kusten varmare.
736. Den specifika värmekapaciteten för aluminium är 920 J / kg ° C. Vad betyder det här?
Detta betyder att för att värma 1 kg aluminium vid 1 ° C, 920 J.
737. Aluminium- och kopparstänger med samma vikt 1 kg kyls med 1 ° C. Hur mycket kommer den inre energin i varje stapel att förändras? Vilken stapel kommer det att förändras mer och med hur mycket?
738. Hur mycket värme behövs för att värma ett kilogram järnämne med 45 °C?

739. Hur mycket värme krävs för att värma 0,25 kg vatten från 30 °C till 50 °C?
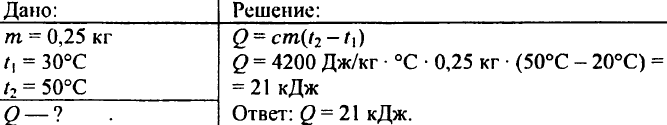
740. Hur kommer den inre energin i två liter vatten att förändras när den värms upp med 5 °C?

741. Hur mycket värme behövs för att värma 5 g vatten från 20°C till 30°C?
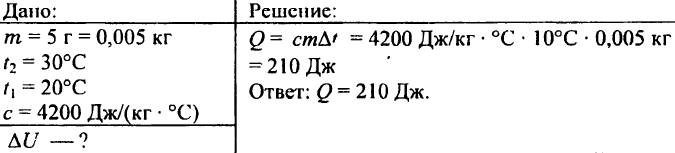
742. Hur mycket värme behövs för att värma en aluminiumkula som väger 0,03 kg vid 72 °C?
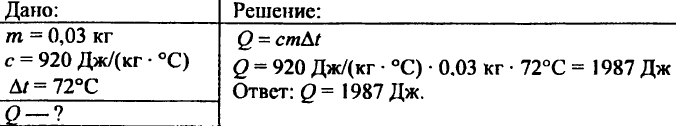
743. Beräkna mängden värme som krävs för att värma 15 kg koppar vid 80 ° C.

744. Beräkna mängden värme som krävs för att värma 5 kg koppar från 10 ° C till 200 ° C.
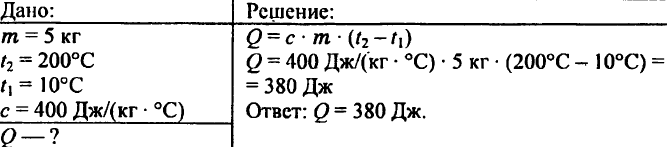
745. Vilken mängd värme krävs för att värma 0,2 kg vatten från 15 ° C till 20 ° C?

746. Vatten som väger 0,3 kg kyls ned med 20 ° C. Hur mycket har vattnets inre energi minskat?

747. Hur mycket värme behövs för att värma 0,4 kg vatten vid en temperatur av 20 ° C till en temperatur av 30 ° C?

748. Vilken mängd värme går åt på att värma upp 2,5 kg vatten vid 20 ° C?
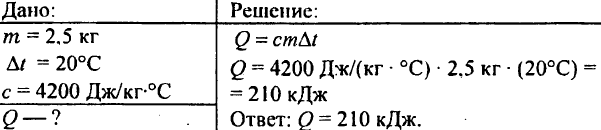
749. Hur mycket värme frigjordes vid kylning av 250 g vatten från 90°C till 40°C?
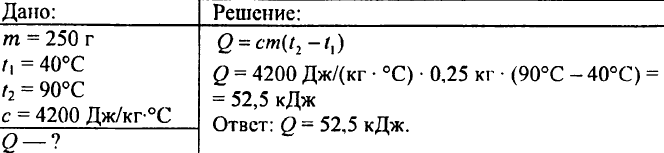
750. Hur mycket värme krävs för att värma 0,015 liter vatten med 1 °C?

751. Beräkna mängden värme som krävs för att värma en 300 m3 damm med 10 ° C?
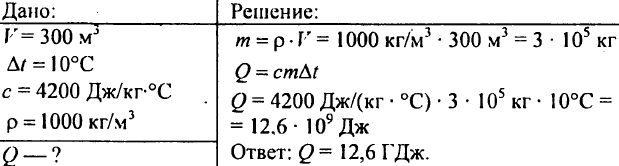
752. Vilken mängd värme ska ges till 1 kg vatten för att höja dess temperatur från 30 ° С till 40 ° С?

753. Vatten med en volym på 10 liter har svalnat från en temperatur på 100 ° C till en temperatur på 40 ° C. Hur mycket värme frigjordes under detta?

754. Beräkna mängden värme som krävs för att värma 1 m3 sand till 60 ° C.

755. Luftvolym 60 m3, specifik värmekapacitet 1000 J / kg ° С, luftdensitet 1,29 kg / m3. Hur mycket värme behövs för att värma upp den till 22°C?

756. Vattnet värmdes med 10°C med 4,20 103 J värme. Bestäm mängden vatten.

757. Vatten som vägde 0,5 kg uppgavs 20,95 kJ värme. Vad var vattentemperaturen om den ursprungliga vattentemperaturen var 20 °C?

758. En kopparkastrull som väger 2,5 kg fylls med 8 kg vatten vid 10 ° C. Hur mycket värme behövs för att vattnet i en kastrull ska koka upp?

759. En liter vatten vid en temperatur av 15 ° C hälls i en kopparskänk som väger 300 g. Hur mycket värme behövs för att värma vattnet i skänken till 85 ° C?
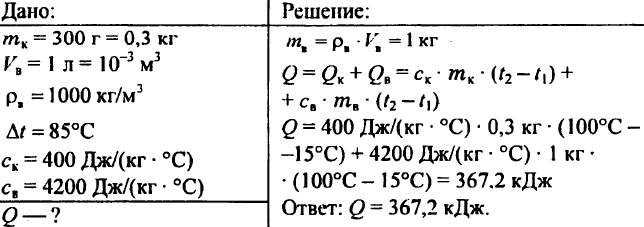
760. En bit uppvärmd granit som väger 3 kg läggs i vatten. Granit överför 12,6 kJ värme till vatten, kyler med 10 ° C. Vad är stenens specifika värme?

761. Varmvatten vid 50°C sattes till 5 kg vatten vid 12°C för att erhålla en blandning med en temperatur på 30°C. Hur mycket vatten tillsattes?

762. Vatten vid 20°C sattes till 3 liter vatten vid 60°C för att erhålla vatten vid 40°C. Hur mycket vatten tillsattes?

763. Vad blir temperaturen på blandningen om du blandar 600 g vatten vid 80 ° C med 200 g vatten vid 20 ° C?

764. En liter vatten vid 90 ° C hälldes i vatten vid 10 ° C, och vattnets temperatur blev 60 ° C. Hur mycket kallt vatten var det?
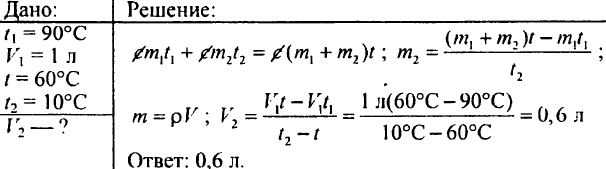
765. Bestäm hur mycket varmt vatten uppvärmt till 60 ° C som ska hällas i kärlet, om kärlet redan innehåller 20 liter kallt vatten vid en temperatur av 15 ° C; temperaturen på blandningen bör vara 40 ° C.
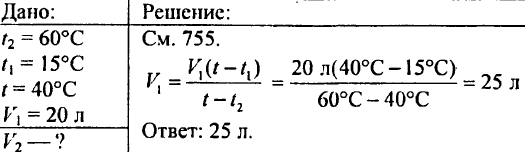
766. Bestäm hur mycket värme som krävs för att värma 425 g vatten vid 20 ° C.

767. Hur många grader värms 5 kg vatten upp om vattnet får 167,2 kJ?

768. Hur mycket värme krävs för att värma m gram vatten vid temperaturen t1 till temperaturen t2?
769. Kalorimetern är fylld med 2 kg vatten vid en temperatur på 15 ° C. Till vilken temperatur kommer kalorimeterns vatten att värmas upp om en mässingsvikt på 500 g, uppvärmd till 100 ° C, sänks ner i den? Den specifika värmekapaciteten för mässing är 0,37 kJ / (kg ° C).

770. Det finns klumpar av koppar, tenn och aluminium av samma volym. Vilken av dessa delar har högst och lägst värmekapacitet?

771. Kalorimetern fylldes med 450 g vatten, vars temperatur var 20 ° C. När 200 g järnspån uppvärmd till 100 ° C sänktes ned i detta vatten blev vattentemperaturen 24 ° C. Bestäm den specifika värmen för sågspånet.

772. En kopparkalorimeter som väger 100 g innehåller 738 g vatten, vars temperatur är 15 ° C. 200 g koppar sänktes i denna kalorimeter vid en temperatur av 100 ° C, varefter temperaturen på kalorimetern steg till 17 ° C. Vad är det specifika värmet för koppar?

773. En stålkula som väger 10 g tas ut ur ugnen och nedsänks i vatten med en temperatur på 10 ° C. Vattentemperaturen steg till 25°C. Vilken temperatur hade bollen i ugnen om vattenmassan var 50 g? Stålets specifika värmekapacitet är 0,5 kJ / (kg ° C).
776. Vatten som vägde 0,95 g vid en temperatur av 80 ° C blandades med vatten som vägde 0,15 g vid en temperatur av 15 ° C. Bestäm temperaturen på blandningen. 779. En stålkutter som vägde 2 kg värmdes till en temperatur av 800 ° C och sänktes sedan ner i ett kärl innehållande 15 liter vatten vid en temperatur av 10 ° C. Till vilken temperatur kommer vattnet i kärlet att värmas upp?

(Obs. För att lösa detta problem är det nödvändigt att komponera en ekvation där den okända temperaturen på vattnet i kärlet efter sänkningen av skäraren tas som den okända.)
780. Vilken temperatur får vattnet om man blandar 0,02 kg vatten vid 15 °C, 0,03 kg vatten vid 25 °C och 0,01 kg vatten vid 60 °C?

781. Uppvärmning av en välventilerad klass kräver en värmemängd 4,19 MJ per timme. Vatten kommer in i värmeradiatorerna vid 80 ° C och lämnar dem vid 72 ° C. Hur mycket vatten behöver du tillföra radiatorerna varje timme?

782. Bly som vägde 0,1 kg vid en temperatur av 100 ° C nedsänktes i en aluminiumkalorimeter som vägde 0,04 kg innehållande 0,24 kg vatten vid en temperatur av 15 ° C. Därefter ställdes temperaturen i kalorimetern till 16 ° C. Vad är blyets specifika värme?

"... - Hur många papegojor får plats i dig, det är din längd.
– Verkligen behövs! Jag kommer inte att svälja så många papegojor! ...”
Från m/f "38 papegojor"
I enlighet med internationella regler SI (international system of measurement units) mäts mängden värmeenergi eller mängden värme i Joule [J], det finns också flera enheter av kiloJoule [kJ] = 1000 J., MegaJoule [MJ] ] = 1 000 000 J, GigaJoule [ GJ] = 1 000 000 000 J., etc. Denna måttenhet för termisk energi är den viktigaste internationella enheten och används oftast i vetenskapliga och vetenskapligt-tekniska beräkningar.
Men alla av oss vet eller åtminstone en gång har hört en annan enhet för att mäta mängden värme (eller bara värme) detta är en kalori, samt kilocalorie, Megacalorie och Gigacalorie, som betyder prefixen kilo, Giga och Mega, se exemplet med Joules ovan. I vårt land, historiskt sett, när man beräknar tariffer för uppvärmning, oavsett om det är uppvärmning med el, gas eller pelletspannor, är det vanligt att överväga kostnaden för exakt en Gigakalori av termisk energi.
Så vad är Gigacaloria, kilowatt, kilowatt * timme eller kilowatt / timme och joule och hur är de relaterade?, får du reda på i den här artikeln.
Så, huvudenheten för termisk energi är, som redan nämnts, Joule. Men innan vi pratar om måttenheterna är det i princip nödvändigt att förklara på hushållsnivå vad värmeenergi är och hur och i vilket syfte att mäta den.
Vi vet alla från barndomen att för att få värme (för att få värmeenergi) måste vi sätta eld på något, så vi brände alla eldar, det traditionella bränslet för en brasa är ved. Sålunda frigörs uppenbarligen termisk energi (värme) vid förbränning av bränsle (vilket som helst: ved, kol, pellets, naturgas, diesel). Men för att värma till exempel olika mängder vatten krävs olika mängd ved (eller annat bränsle). Det är klart att för att värma två liter vatten räcker det med några ved, och för att laga en halv hink soppa för hela lägret måste du fylla på med flera vedbuntar. För att inte mäta så strikta tekniska värden som mängden värme och värmen från förbränning av bränsle med buntar med ved och hinkar med soppa, bestämde sig värmeingenjörer för att klargöra och beställa och gick med på att uppfinna en enhet för mängden värme . För att denna enhet skulle vara densamma överallt definierades den enligt följande: för att värma ett kilogram vatten med en grad under normala förhållanden (atmosfärstryck), krävs 4 190 kalorier, eller 4,19 kilokalorier, därför för att värma ett gram av vatten, tusen gånger mindre värme räcker - 4,19 kalorier.
En kalori är relaterad till den internationella enheten för termisk energi - Joule genom följande förhållande:
1 kalori = 4,19 Joule.
För att värma 1 gram vatten med en grad krävs alltså 4,19 joule värmeenergi och för att värma ett kilo vatten 4 190 joule värme.
Inom tekniken, tillsammans med måttenheten för termisk (och annan) energi, finns det en effektenhet och, i enlighet med det internationella systemet (SI), är det Watt. Begreppet kraft gäller även för värmeapparater. Om en värmeanordning kan ge 1 Joule värmeenergi på 1 sekund, är dess effekt 1 Watt. Effekt är en enhets förmåga att producera (skapa) en viss mängd energi (i vårt fall värmeenergi) per tidsenhet. Låt oss återgå till vårt exempel med vatten, för att värma ett kilogram (eller en liter, i fallet med vatten, är ett kilogram en liter) vatten per en grad Celsius (eller Kelvin, ingen skillnad), behöver vi en effekt på 1 kilokalori eller 4 190 J. termisk energi. För att värma ett kilo vatten på 1 sekunds tid med 1 grad grader Celsius behöver vi en enhet med följande effekt:
4190 J/1 s. = 4 190 W. eller 4,19 kW.
Om vi vill värma vårt kilogram vatten med 25 grader på samma sekund, då behöver vi en effekt tjugofem gånger mer, d.v.s.
4,19 * 25 = 104,75 kW.
Således kan vi dra slutsatsen att en pelletspanna med en kapacitet på 104,75 kW. värmer 1 liter vatten 25 grader på en sekund.
Eftersom vi kom till Watt och kiloWatt bör vi också lägga ett ord om dem. Som redan nämnts är Watt en effektenhet, inklusive värmeeffekten hos en panna, men förutom pelletspannor och gaspannor är också elektriska pannor bekanta för mänskligheten, vars effekt mäts naturligtvis i samma kilowatt och de förbrukar inte pellets eller gas, och el, vars mängd mäts i kilowattimmar. Rätt stavning av enheten för energi kiloWatt * timme (nämligen, kiloWatt multipliceras med en timme, inte dividerat), att skriva kW / timme är ett misstag!
I elpannor omvandlas elektrisk energi till värme (den så kallade Joule-värmen), och om pannan förbrukade 1 kW * timme el, hur mycket värme genererade den då? För att svara på denna enkla fråga måste du göra en enkel beräkning.
Konvertera kilowatt till kilojoule / sekunder (kilojoule per sekund) och timmar till sekunder: på en timme, 3600 sekunder får vi:
1 kW * timme = [1 kJ/s] * 3 600 s. = 1 000 J * 3 600 s = 3 600 000 Joule eller 3,6 MJ.
Så,
1 kW * timme = 3,6 MJ.
I sin tur, 3,6 MJ / 4,19 = 0,859 Mcal = 859 kcal = 859 000 cal. Energi (termisk).
Låt oss nu gå vidare till Gigacaloria, vars pris värmetekniker gillar att beräkna på olika typer av bränsle.
1 Gcal = 1 000 000 000 cal.
1 000 000 000 kal. = 4,19 * 1 000 000 000 = 4 190 000 000 J = 4 190 MJ. = 4,19 GJ.
Eller, med vetskapen om att 1 kW * timme = 3,6 MJ, räknar vi om 1 Gigacaloria per kilowatt * timme:
1 Gcal = 4190 MJ / 3,6 MJ = 1 163 kW * timmar!
Om du efter att ha läst den här artikeln bestämmer dig för att rådgöra med en specialist från vårt företag om något problem som rör värmeförsörjning, då Här!
Källa: teplo-en.ru

 Edith Piaf: biografi, bästa sånger, intressanta fakta, lyssna på berättelsen om Edith Piaf
Edith Piaf: biografi, bästa sånger, intressanta fakta, lyssna på berättelsen om Edith Piaf Svartvinbärsgelé
Svartvinbärsgelé Hur många gånger om dagen ska en vuxen kissa - kissa?
Hur många gånger om dagen ska en vuxen kissa - kissa?