Övergångar mellan aggregationstillstånd. Förändring av ett ämnes aggregativa tillstånd Övergång av ett ämne från gas till fast ämne
Övergången av ett ämne från ett gasformigt till ett flytande tillstånd kallas kondensation. Under vissa förhållanden kan ämnen förändras från ett tillstånd till ett annat. Övergång från ett aggregationstillstånd till ett annat. Den omvända sublimeringsprocessen (övergången av ett ämne från en gas till ett fast tillstånd) kallas desublimering. Det finns vissa ämnen som går från ett fast tillstånd direkt till ett gasformigt tillstånd, förbi vätskefasen. Denna process kallas sublimering eller sublimering.
Avdunstning kan ske vid vilken temperatur som helst. Övergången av vätska till ånga, som sker genom hela kroppens volym, kallas kokning, och temperaturen vid vilken vätskan kokar kallas kokpunkten. Om andra parametrar i den yttre miljön (särskilt tryck) förblir konstanta, ändras inte kroppstemperaturen under processen för smältning (kristallisation) och kokning.
2. Flytande tillstånd
Det finns andra aggregationstillstånd, till exempel Bose-Einstein-kondensatet. Ett särdrag är frånvaron av en skarp gräns för övergången till plasmatillståndet. Definitioner av aggregationstillstånd är inte alltid strikta. Fasta ämnen delas in i kristallina och amorfa. Kristaller kännetecknas av rumslig periodicitet i arrangemanget av jämviktspositioner för atomer, vilket uppnås genom närvaron av långdistansordning och kallas ett kristallgitter.
1. Fast tillstånd
Enligt klassiska begrepp är det stabila tillståndet (med ett minimum av potentiell energi) för ett fast ämne kristallint. Ett specialfall av det amorfa tillståndet är det glasartade tillståndet. Det flytande tillståndet anses vanligtvis vara mellanliggande mellan ett fast ämne och en gas. Formen på flytande kroppar kan helt eller delvis bestämmas av att deras yta beter sig som ett elastiskt membran.
Som regel har ett ämne i flytande tillstånd endast en modifiering. Liksom gas är vätskor också mestadels isotropa. Det finns dock vätskor med anisotropa egenskaper - flytande kristaller. Förutom den isotropa, så kallade normala fasen, har dessa ämnen, mesogener, en eller flera ordnade termodynamiska faser, som kallas mesofas.
3. Gasformigt tillstånd
Molekyler i en gas kan röra sig fritt och snabbt. Det gasformiga tillståndet kännetecknas av att det inte bibehåller vare sig form eller volym. Gas fyller allt tillgängligt utrymme och tränger in i alla skrymslen och vrår. Detta är ett tillstånd som är karakteristiskt för ämnen med låg densitet.
Ur mikroskopisk synvinkel är en gas ett tillstånd av materia där dess individuella molekyler interagerar svagt och rör sig kaotiskt. Liksom vätskor har gaser fluiditet och motstår deformation. Till skillnad från vätskor har gaser inte en fast volym och bildar inte en fri yta, utan tenderar att fylla hela den tillgängliga volymen (till exempel ett kärl). Vissa ämnen har inte ett gasformigt tillstånd.
Materiens fjärde tillstånd kallas ofta plasma. Flytande kristaller har samtidigt egenskaperna hos både vätskor (fluiditet) och kristaller (anisotropi). Strukturellt är flytande kristaller viskösa vätskor som består av långsträckta eller skivformade molekyler, ordnade på ett visst sätt genom hela volymen av denna vätska.
Avdunstning och kondensation
I sin tur är nematik uppdelad i nematiska och kolesteriska flytande kristaller. Eftersom heliumatomer är bosoner tillåter kvantmekaniken att ett godtyckligt antal partiklar är i ett tillstånd.
Eftersom tillståndsenergin är diskret, kan en atom inte ta emot någon energi, utan bara en som är lika med energigapet mellan angränsande energinivåer. Men vid låga temperaturer kan kollisionsenergin vara mindre än detta värde, vilket leder till att energiförlust helt enkelt inte kommer att inträffa.
Man tror också att i universums utveckling föregick glasmatillståndet kvark-gluonplasman, som existerade under de första miljondelar av en sekund omedelbart efter Big Bang. Under djupkylning omvandlas vissa (inte alla) ämnen till ett supraledande eller superflytande tillstånd. Ett fundamentalt annorlunda tillstånd av materia, som bara består av neutroner.
Diffusionskoefficienten har i detta fall ett värde mellan vätska och gas. Ämnen i superkritiskt tillstånd kan användas som substitut för organiska lösningsmedel i laboratorie- och industriprocesser.
Material från Knowledge Hypermarket
Som ett resultat består materia i neutrontillståndet helt av neutroner och har en densitet i storleksordningen kärnkraft. MeV och högre) i neutrontillståndet börjar olika mesoner födas och förintas. Med en ytterligare ökning av temperaturen uppstår avgränsning, och ämnet övergår i tillståndet av kvark-gluonplasma. Den består inte längre av hadroner, utan av att ständigt födas och försvinna kvarkar och gluoner.
Vad är en "trippelpunkt" och hur bestämmer man dess koordinater? Experiment visar att det för varje ämne finns förhållanden (tryck och temperatur) under vilka ånga, vätska och kristall kan samexistera samtidigt under en godtyckligt lång tid. Om du till exempel placerar vatten med flytande is i ett slutet kärl vid noll grader, så kommer både vatten och is att avdunsta in i det fria utrymmet. Men vid ett ångtryck av 0,006 atm. (detta är deras "egna" tryck, utan att ta hänsyn till trycket som skapas av luften) och en temperatur på 0,01 ° C, kommer ökningen av massan av ånga att sluta. Från och med detta ögonblick kommer is, vatten och ånga att behålla sina massor på obestämd tid. Detta är trippelpunkten för vatten (vänster diagram). Om vatten eller ånga placeras i förhållandena i det vänstra området kommer de att bli is. Om du lägger till en vätska eller ett fast ämne till den "nedre regionen" får du ånga. I rätt område kommer vatten att kondensera och is smälter.
Ett liknande diagram kan konstrueras för vilket ämne som helst. Syftet med sådana diagram är att svara på frågan: vilket tillstånd av materia kommer att vara stabilt vid sådant och sådant tryck och sådan och sådan temperatur. Till exempel är diagrammet till höger för koldioxid. Trippelpunkten för detta ämne har en "tryck"-koordinat på 5,11 atm, det vill säga betydligt större än normalt atmosfärstryck. Därför kan vi under normala förhållanden (tryck 1 atm) bara observera övergångar "under trippelpunkten", det vill säga den oberoende omvandlingen av ett fast ämne till en gas. Vid ett tryck på 1 atm sker detta vid en temperatur på –78 °C (se de streckade koordinatlinjerna under trippelpunkten).
Vi lever alla "nära" värdena för "normala förhållanden", det vill säga i första hand vid ett tryck nära en atmosfär. Därför, om atmosfärstrycket är lägre än trycket som motsvarar trippelpunkten, när kroppen värms upp, kommer vi inte att se vätska - det fasta ämnet kommer omedelbart att förvandlas till ånga. Det är precis så "torris" beter sig, vilket är väldigt bekvämt för glassförsäljare. Glassbriketter kan läggas i lager med bitar av "torris" och var inte rädd för att glassen ska bli blöt. Om trycket som motsvarar trippelpunkten är mindre än atmosfärstrycket klassificeras ämnet som "smältande" - när temperaturen stiger förvandlas det först till vätska och kokar sedan.
Som du kan se beror egenskaperna hos aggregerade omvandlingar av ämnen direkt på hur de nuvarande värdena för tryck och temperatur relaterar till koordinaterna för "trippelpunkten" på tryck-temperaturdiagrammet.
Och avslutningsvis, låt oss nämna ämnen som du känner till som alltid sublimeras under normala förhållanden. Detta är jod, grafit, "torris". Vid tryck och temperaturer som skiljer sig från normalt kan dessa ämnen observeras i flytande och till och med kokande tillstånd.
(C) 2013. Fizika.ru med deltagande av A.V. Kuznetsova (Samara)
Låt oss betrakta tre aggregationstillstånd: fast, flytande och gasformig och två övergångar till dem.
Fasövergång "fast - flytande"
Från skolfysikkursen är fyra fakta kända om denna övergång.
Fakta ett:övergången av ett ämne från ett fast tillstånd (fas) till en vätska kallas smältande, och tvärtom – kristallisation.
Fakta två: Vid smältning absorberar systemet värme, och när det stelnar avger det värme.
Fakta tre: Under smältningsprocessen (kristallisation) förblir systemets temperatur konstant tills hela systemet är smält. Denna temperatur kallas smältpunkt.
Fakta fyra: smältningslag: mängden värme δQ som krävs för att smälta ett ämne med massa dm är proportionell mot denna massa:
| . | (6.3.1) |
Proportionalitetskoefficienten λ är en konstant som endast beror på systemets substans och kallas specifik fusionsvärme.
Denna lag är också giltig för kristallisation, men med en skillnad: δ F i detta fall värmen som genereras av systemet. Därför kan lagen i generaliserad form skrivas:
Förändringen i entropi under denna fasövergång kan hittas helt enkelt genom att betrakta processen jämvikt.Detta är en helt acceptabel approximation, om vi antar att temperaturskillnaden mellan systemet och objektet som tillför värme till systemet inte är för stor, mycket mindre än smältpunkten. Då kan vi använda den termodynamiska betydelsen av entropi: ur termodynamikens synvinkel är entropi en funktion av systemets tillstånd, vars förändring d S i en elementär jämviktsprocess är lika med förhållandet mellan värmedelen δ F, som systemet tar emot i denna process, till systemtemperaturen T:
Genom att ersätta uttrycket för δQ här får vi:
Av denna formel följer att under smältning ökar entropin, och under kristalliseringen minskar den. Den fysiska innebörden av detta resultat är ganska tydlig: fasområdet för en molekyl i ett fast ämne är mycket mindre än i en vätska, eftersom i ett fast ämne har varje molekyl endast tillgång till ett litet område av utrymmet mellan intilliggande noder i kristallgittret, och i en vätska upptar molekyler hela region av rymden. Därför, vid samma temperatur, är entropin för en fast kropp mindre än entropin för en vätska. Det betyder att ett fast ämne är ett mer ordnat och mindre kaotiskt system än en vätska.
Fasövergång "vätska - gas"
Denna övergång har alla egenskaper hos en fast-vätskeövergång.
Det finns fyra fakta som är bekanta från skolans fysikkurser.
Fakta ett:övergången av ett ämne från en vätska till gasfas kallas förångning, och den omvända övergången kallas kondensation.
Fakta två: Vid avdunstning absorberar systemet värme, och vid kondensering förlorar det.
Fakta tre: Förångnings- och kondensationsprocesserna sker inom ett brett temperaturområde, men de är en fasövergång endast när processen involverar hela massan av ämnet. Detta händer vid en viss temperatur T k, som kallas kokpunkt. Varje ämne har sin egen kokpunkt. Under vätske-gas fasövergången förblir temperaturen konstant och lika med kokpunkten tills hela systemet går från en fas till en annan.
Fakta fyra: avdunstningens lag: den mängd värme δQ som krävs för att förånga ett ämne med massan dm, och som är proportionell mot denna massa:
Proportion faktor r i detta uttryck finns det en konstant beroende på systemets substans, kallas det specifika avdunstningsvärmet.
Denna lag gäller även för kondens, men med en skillnad: δ F i detta fall värmen som genereras av systemet. Därför kan förångningslagen skrivas i allmän form:
| (6.3.3) |
Där plustecknet hänvisar till avdunstning, och minustecknet hänvisar till kondens.
Tillämpningen av entropi i denna process kan hittas helt enkelt genom att betrakta processen som jämvikt. Och återigen, detta är en helt acceptabel approximation, förutsatt att temperaturskillnaden mellan systemet och "leverantören" av värme är liten, d.v.s. mycket lägre än kokpunkten. Sedan
| . | 6.3.4 |
Av formel (6.3.4) följer att under avdunstning ökar entropin, och under kondensation minskar den.
Den fysiska innebörden av detta resultat är skillnaden i fasregionen för molekylen i vätska och gas. Även om i vätskor och gaser varje molekyl har tillgång till hela området av utrymme som upptas av systemet, är denna region i sig betydligt mindre för en vätska än för en gas. I en vätska håller attraktionskrafterna mellan molekylerna dem på ett visst avstånd från varandra. Därför, även om varje molekyl har möjlighet att fritt migrera genom det område av utrymme som upptas av vätskan, har den inte möjlighet att "bryta sig loss från kollektivet" av andra molekyler: så snart den bryter sig loss från en molekyl, en annan lockas omedelbart. Därför beror volymen av vätska på dess kvantitet och är inte på något sätt relaterad till kärlets volym.
Gasmolekyler beter sig olika. De har mycket mer frihet, det genomsnittliga avståndet mellan dem är sådant att attraktionskrafterna är mycket små, och molekylerna "märker varandra" endast under kollisioner. Som ett resultat upptar gasen alltid hela kärlets volym.
Därför, vid lika temperaturer, är fasområdet för gasmolekyler betydligt större än fasområdet för vätskemolekyler, och gasens entropi är större än vätskans entropi. Gas, jämfört med vätska, är ett mycket mindre ordnat, mer kaotiskt system.
Det är viktigt att veta och förstå hur övergångar mellan materietillstånd uppstår. Vi visar ett diagram över sådana övergångar i figur 4.
5 - sublimering (sublimering) - övergång från ett fast till ett gasformigt tillstånd, förbi vätskan;
6 - desublimering - övergång från ett gasformigt tillstånd till ett fast tillstånd, förbi det flytande tillståndet.
B. 2 Issmältning och vattenfrysning (kristallisation)
Om du lägger is i en kolv och börjar värma den med en brännare kommer du att märka att dess temperatur börjar stiga tills den når smältpunkten (0 o C). Sedan kommer smältprocessen att börja, men temperaturen på isen kommer inte att öka, och först efter att smältningsprocessen för all is har avslutats kommer temperaturen på det resulterande vattnet att börja öka.
Definition. Smältande- processen för övergång från fast till flytande. Denna process sker vid en konstant temperatur.
Temperaturen vid vilken ett ämne smälter kallas smältpunkt och är ett uppmätt värde för många fasta ämnen, och därför ett tabellvärde. Till exempel är smältpunkten för is 0 o C, och smältpunkten för guld är 1100 o C.
Den omvända processen till smältning - kristallisationsprocessen - övervägs också bekvämt med exemplet att frysa vatten och förvandla det till is. Om du tar ett provrör med vatten och börjar kyla det, kommer det först att minska temperaturen på vattnet tills det når 0 o C, och sedan fryser det vid en konstant temperatur), och efter fullständig frysning, ytterligare kylning av den bildade isen.
Om de beskrivna processerna betraktas ur synvinkeln av kroppens inre energi, spenderas all energi som kroppen tar emot under smältning på att förstöra kristallgittret och försvaga intermolekylära bindningar, så att energi inte spenderas på att ändra temperatur , men på att ändra strukturen hos ämnet och samspelet mellan dess partiklar. Under kristalliseringsprocessen sker energiutbyte i motsatt riktning: kroppen avger värme till miljön och dess inre energi minskar, vilket leder till en minskning av partiklars rörlighet, en ökning av interaktionen mellan dem och stelning av partiklar. kroppen.
 Smält- och kristallisationsgraf
Smält- och kristallisationsgraf
Det är användbart att grafiskt kunna avbilda processerna för smältning och kristallisering av ett ämne på en graf. Grafens axlar är: abskissaxeln är tid, ordinataaxeln är ämnets temperatur. Som ämne som studeras kommer vi att ta is vid en negativ temperatur, d.v.s. is som, när den tar emot värme, inte omedelbart börjar smälta, utan kommer att värmas upp till smälttemperaturen. Låt oss beskriva de områden på grafen som representerar individuella termiska processer:
Initialt tillstånd - a: uppvärmning av is till en smältpunkt av 0 o C;
a - b: smältprocess vid en konstant temperatur av 0 o C;
b - en punkt med en viss temperatur: uppvärmning av vattnet som bildas från is till en viss temperatur;
En punkt med en viss temperatur - c: kylning av vatten till en fryspunkt på 0 o C;
c - d: processen att frysa vatten vid en konstant temperatur på 0 o C;
d - sluttillstånd: kylning av is till en viss negativ temperatur.
Under normala förhållanden finns vilket ämne som helst i ett av tre tillstånd - fast, flytande eller gasformig ( centimeter. Aggregerade materiatillstånd). Var och en av dessa villkor motsvarar sin egen struktur av bindningar mellan molekyler och/eller atomer, kännetecknad av en viss bindningsenergi mellan dem. För att ändra denna struktur krävs antingen ett inflöde av termisk energi från utsidan (till exempel under smältningen av ett fast ämne), eller ett utflöde av energi utåt (till exempel under kristallisation).
Om vi till att börja med tar en fast substans, förstår vi spekulativt att molekylerna/atomerna i den är bundna till någon form av stel kristallin eller amorf struktur - med lätt uppvärmning börjar de bara "skaka" runt sin fasta position (ju högre temperatur , desto större amplitud av vibrationer). Med ytterligare uppvärmning av ämnet lossnar molekylerna mer och mer tills de slutligen bryter sig loss från sitt "hem" och går "fritt flytande". Det är vad det är smältande eller smältande fast till vätska. Tillförseln av energi som behövs för att smälta ett ämne kallas fusionsvärme.
Grafen över temperaturförändringen för ett fast ämne när det passerar sin smältpunkt är i sig mycket intressant. Upp till smältpunkten, när de värms upp, svänger atomerna/molekylerna runt sin fasta position mer och mer, och ankomsten av varje ytterligare del av termisk energi leder till en ökning av temperaturen hos det fasta ämnet. Men när ett fast ämne når sin smältpunkt förblir det vid denna temperatur under en tid, trots det fortsatta värmeflödet, tills det ackumulerar en tillräcklig mängd termisk energi för att bryta stela intermolekylära bindningar. Det vill säga i processen Fasövergång ett ämne från ett fast tillstånd till en vätska absorberas av det utan att öka temperaturen, eftersom allt går åt till att bryta intermolekylära bindningar. Det är därför en isbit i en cocktail, även i det varmaste vädret, förblir isig i temperatur tills allt har smält. Samtidigt, när isbiten smälter, tar isbiten bort värme från cocktailen som omger den (och kyler den därigenom till en behaglig temperatur), och får själv den energi som krävs för att bryta intermolekylära bindningar och i slutändan självförstöra.
Mängden värme som krävs för att smälta eller förånga en enhetsvolym av en fast eller vätska kallas resp. latent fusionsvärme eller latent förångningsvärme. Och kvantiteterna här är ibland avsevärda. Till exempel, för att värma 1 kg vatten från 0°C till 100°C krävs "bara" 420 000 joule (J) värmeenergi, och för att förvandla detta kilogram vatten till 1 kg ånga med en temperatur lika med samma 100 °C , - så mycket som 2 260 000 J energi.
Efter att den fasta massan helt har förvandlats till en vätska kommer ytterligare värme igen att leda till en ökning av ämnets temperatur. I flytande tillstånd är ett ämnes molekyler fortfarande i nära kontakt, men de stela intermolekylära bindningarna mellan dem bryts, och växelverkanskrafterna som håller ihop molekylerna är flera storleksordningar svagare än i ett fast ämne, så molekylerna börjar röra sig ganska fritt i förhållande till varandra. Ytterligare tillförsel av termisk energi för vätskan till fasen kokande, och aktiv avdunstning eller förångning.
Och återigen, som beskrevs i fallet med smältning eller smältning, går all den extra energi som tillförs under en tid på att bryta vätskebindningarna mellan molekylerna och frigöra dem till ett gasformigt tillstånd (vid konstant kokpunkt). Energin som spenderas på att bryta dessa till synes svaga band är den sk. latent förångningsvärme - Det krävs också en betydande summa (se exemplet ovan).
Alla samma processer under utflödet av energi (kylning) av ett ämne sker i omvänd ordning. Först kyls gasen när temperaturen sjunker, och detta fortsätter tills den når kondenseringspunkter- temperatur vid vilken den startar flytande, - och den är exakt lika med förångningstemperaturen (kokningstemperaturen) för motsvarande vätska. Under kondensering, när krafterna för ömsesidig attraktion mellan molekyler börjar ha företräde framför energin av termisk rörelse, börjar gasen att förvandlas till en vätska - "kondensera". I det här fallet, den så kallade specifika kondensationsvärme - det är exakt lika med det latenta specifika förångningsvärmet, vilket redan har diskuterats. Det vill säga hur mycket energi du lagt på att förånga en viss massa vätska, exakt samma mängd energi som ångan kommer att avge i form av värme när den kondenserar tillbaka till vätskan.
Det faktum att mängden värme som frigörs vid kondensering är mycket hög är ett lätt verifierbart faktum: höj bara handflatan till pipen på en kokande vattenkokare. Förutom värmen från själva ångan kommer din hud också att drabbas av värmen som frigörs till följd av att den kondenseras till flytande vatten.
När vätskan svalnar ytterligare till fryspunkter(vars temperatur är lika med smältpunkt), kommer processen att frigöra termisk energi utanför återigen börja utan att sänka temperaturen på själva ämnet. Denna process kallas kristallisation, och det frigör exakt samma mängd värmeenergi som tas från miljön under smältning (övergången av ett ämne från en fast fas till en vätska).
Det finns en annan typ av fasövergång - från ett ämnes fasta tillstånd direkt till det gasformiga tillståndet (förbi vätskan). Denna fastransformation kallas sublimering, eller sublimering. Det vanligaste exemplet: fuktig tvätt hängde på tork i kylan. Vattnet i det kristalliseras först till is, och sedan - under inverkan av direkt solljus - förångas mikroskopiska iskristaller helt enkelt och går förbi vätskefasen. Ett annat exempel: på rockkonserter används "torris" (fryst koldioxid CO 2) för att skapa en rökskärm - den avdunstar direkt i luften, omsluter de uppträdande musikerna och går även förbi vätskefasen. Följaktligen tar det sublimationsenergi.
 "Det beslutades att konfiskera alla meteoriter" Km över öknen till fots
"Det beslutades att konfiskera alla meteoriter" Km över öknen till fots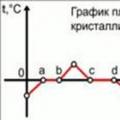 Förändring av ett ämnes aggregativa tillstånd Övergång av ett ämne från gas till fast ämne
Förändring av ett ämnes aggregativa tillstånd Övergång av ett ämne från gas till fast ämne Vetenskapligt forskningsarbete inom kemi
Vetenskapligt forskningsarbete inom kemi